BAB I
PENDAHULUAN
1.1 Latar Belakang
Indonesia
mengimpor hampir seluruh kebutuhan enzim (sekitar 90%) dari luar negeri. Dari
aspek pasar, kebutuhan enzim di Indonesia terus meningkat sebagaimana dapat
dilihat dari nilai impor. Menurut Badan Pusat Statistik, impor untuk produksi
farmasetika tahun 2007 adalah sebesar 2,988 trilyun rupiah, tahun 2008 menjadi
3,391 trilyun rupiah dan pada tahun 2011 diperkirakan menjadi 4,55 trilyun
rupiah. Kebutuhan enzim dunia terus meningkat yaitu sebesar 6,5% per tahun dan
menjadi $5,1 miliar pada tahun 2009 (Trismilah et al., 2014).
Enzim adalah protein yang berfungsi sebagai katalisator untuk
reaksi-reaksi kimia didalam sistem biologi. Katalisator mempercepat reaksi
kimia. Walaupun katalisator ikut serta dalam reaksi, ia kembali ke keadaan
semula bila reeaksi telah selesai. Enzim adalah katalisator protein untuk
reaksi-reaksi kimia pasa sistem biologi. sebagian besar reaksi tersebut tidak
dikatalis oleh enzim (Indah, 2004).
Enzim adalah substansi yang dihasilkan oleh sel-sel hidup dan
berperan sebagai katalisator pada reaksi kimia yang berlangsung dalam
mikroorganisme. Katalisator adalah substansi yang mempercepat reaksi tetapi
pada akhir reaksi, substansi tersebut tidak berubah. Semua sel menghasilkan
sejumlah besar enzim yang berbeda-beda dan fungsi sel ditentukan oleh enzim
yang terdapat didalamnya. Beberapa sel melepaskan enzim yang berperan diluar
sel, sebagai contoh sel-sel dibagian permukaaan saluran pencernaan menghasilkan
enzim yang mencerna makanan (Wibowo, 2006).
Sistem tata nama enzim-enzim sebelumnya menghasilkan susunan yang
membingungkan dari nama-nama yang tidak pasti artinya dan umumnya tidak
mempunyai keterangan apa-apa seperti emulsin, peptin dan zimase. enzim selanjutnya
diberi nama subtratnya dengan menambah akhiran “ase”. Jadi enzim-enzim yang
memecahkan pati (amilon) disebut amilase; yang memecahkan lemak (lipos),
lipase; dan yang bekerja pada protein, protease. Golongan enzim-enzim diberi
nama oksidase, glikodase, dehidrogenase, dekarboksilase, dan sebagainya. Gambaran
utama sistem IUB (Internasional Union of Biochemistry) untuk klasifikasi enzim dibagi
dalam 6 kelas utama yang terdiri dari oksireduktase, hidrolase, liase,
isomerase, ligase dan transferase (Indah, 2004).
1.2
Rumusan Masalah
Berdasarkan uraian latar belakang di atas maka dapat ditentukan rumusan
masalah dalam makalah ini seperti berikut.
1. Apa pengertian enzim transferase?
2. Apa saja contoh enzim transferase?
3. Apa fungsi enzim transferase?
1.3
Tujuan
Berdasarkan uraian rumusan masalah di atas maka dapat ditentukan tujuan
dalam makalah ini seperti berikut.
1. Mengetahui pengertian enzim transferase.
2. Mengetahui contoh enzim transferase.
3. Mengetahui fungsi enzim transferase.
BAB II
PEMBAHASAN
2.1 Pengertian Enzim
Transferase
Enzim transferase adalah enzim-enzim yang mengkatalisis pemindahan
suatu gugus, G (lain dari hidrogen), antara sepasang substrat S dan S’.
S-G + S’ = S’-G + S
Dalam kelas ini termasuk enzim-enzim yang mengkatalisis pemindahan
gugus satu karbon, residu aldehida atauketon, dan gugus yang mengandung asil,
alkil, glikosil, fosfor atau sulfur. Beberapa subkelas penting adalah:
a. Asiltransferase
Misalnya asetil-KoA: kolin
O-aseetiltransferase [kolin asiltrasferase]
Asetil-KoA + kolin = KoA +
asetilkolin
b. Glikosiltransferase
Misalnya alfa-1,4-glukan:
ortofosfat glikosil transferace [fosforilase]
(alfa-1,4,-glukan)n +
ortofosfat = (alfa-1,4 glikosil)n-1 + alfa-D-glukosa-1-fosfat
c. Enzim-enzim yang
mengkatalisis pemindahan gugus yang mengandung fosfat
Misalnya: ATP: D-heksosa-6fosfotransferase
[heksokinase]
ATP + D-heksosa = ADP +
D-heksosa-6fosfat
2.2 Contoh Enzim Transferase
2.2.1
UDP-Glucuronosyltransferase
UDP-glucuronosyltransferases (UGTs) merupakan salah satu kunci
enzim dari metabolisme berbagai eksogen serta senyawa endogen. Reaksi konjugasi
dikatalisasi oleh superfamili dari enzim ini berfungsi sebagai jalur
detoksifikasi yang paling penting untuk spektrum yang luas dari obat-obatan,
bahan kimia, karsinogen dan metabolitnya teroksidasi dan berbagai bahan kimia
lingkungan pada semua vertebrata. Selain itu, UGTs yang terlibat dalam regulasi
dari beberapa senyawa endogen aktif seperti asam empedu atau hydroxysteroids
karena inaktivasinya melalui glucuronidation (Miners dan McMackenzie, 1991;
Kiang et al., 2005 dalam Jancova dan Siller, 2012). Pada manusia,
hampir 40-70% dari obat klinis digunakan glucuronidation (Wells et al.,
2004 dalam Jancova dan Siller, 2012).
 |
Gambar 1. Pembentukan glukuronida
(Sumber: Jancova dan Siller, 2012)
|
Sulfoconjugation (atau sulfonasi) merupakan jalur penting
dalam metabolisme baik eksogen dan endogen. Reaksi sulfonasi pertama diakui,
yaitu oleh Baumann pada tahun 1876. Baumann mendeteksi fenil sulfat dalam air
seni pasien yang telah diberikan fenol. Reaksi sulfonasi dimediasi oleh
supergen sebuah keluarga enzim yang disebut sulfotransferases. Secara umum,
enzim ini mengkatalisis transfer sulfonat (SO3-) dari universal
sulfonat donor 3'-5'phosphoadenosine phosphosulfate (PAPS) ke hidroksil atau
amino kelompok molekul akseptor (Jancova dan Siller, 2012).
 |
Gambar 2. Pembentukan sulfat (R-O-SO3-) dan sulfamates (R1-NR2-SO3-)
(Sumber: Jancova dan Siller, 2012)
|
Aktivitas glutathione transferase pertama di sitosol hati
tikus oleh Booth di awal 1960-an, transferase glutathione (sinonim glutathione
S-transferase; GSTs) telah dipelajari secara rinci. Tidak diragukan lagi,
glutathione transferase memainkan peran penting dalam metabolisme terapi
tertentu, detoksifikasi karsinogen lingkungan dan intermediet reaktif terbentuk
dari berbagai bahan kimia oleh enzim xenobiotik-metabolising lainnya.
Selanjutnya, GSTs merupakan suatu pertahanan intraseluler penting melawan stres
oksidatif dan terlibat dalam sintesis serta metabolisme beberapa turunan dari
asam arakidonat dan steroid (van Bladeren, 2000 dalam Jancova dan
Siller, 2012).
 |
Gambar 3. Pembentukan asam mercapturic
(Sumber: Jancova dan Siller, 2012)
|
Pada manusia, reaksi asetilasi dikatalisis oleh dua
isoenzim N-asetiltransferase (Nat), N-acetyltransferase 1 (NAT1) dan 2 (NAT2). Enzim
sitosol ditemukan banyak pada jaringan dari berbagai spesies. The NAT1 dan NAT2
gen manusia yang terletak di kromosom 8 pter-Q11 dan berbagi 87% urut coding
homologi (Blum et al., 1990 dalam Jancova dan Siller, 2012). NAT1
dan NAT2 memiliki kekhususan substrat yang berbeda dan sangat berbeda dalam hal
organ dan jaringan distribusi. NAT2 protein terutama di hati (Grant et al.,
1990 dalam Jancova dan Siller, 2012) dan usus (Hickman et al.,
1998 dalam Jancova dan Siller, 2012). Ekspresi NAT1 manusia telah
terdeteksi di hati, kandung kemih, sistem pencernaan, sel darah, plasenta,
kulit, otot rangka, gingiva (Dupret dan Lima, 2005), jaringan payudara, prostat
dan paru-paru oleh sejumlah metode (Sim et al., 2008 dalam
Jancova dan Siller, 2012).
 |
Gambar 4. Reaksi katalis oleh N-Acetyltransferase
(Sumber: Jancova dan Siller, 2012)
|
2.2.5
Methyltransferase
Metilasi adalah jalur umum tetapi umumnya kecil
biotransformasi xenobiotik. Tidak seperti kebanyakan reaksi konjugasi lainnya,
metilasi tidak secara dramatis mengubah kelarutan substrat dan hasil dalam
senyawa aktif. Metilasi terlibat dalam metabolisme senyawa endogen kecil
seperti neurotransmitter tetapi juga berperan dalam metabolisme makromolekul
misalnya asam nukleat dan dalam biotransformasi obat-obatan tertentu. Sejumlah
besar dari kedua senyawa endogen dan eksogen dapat menjalani N-, O-, S dan
arsenik-metilasi selama metabolisme (Feng et al., 2010 dalam
Jancova dan Siller, 2012). Co-faktor yang dibutuhkan untuk membentuk metil
konjugat adalah S-adenosylmethionine (SAM), yang terutama dibentuk oleh kondensasi
ATP dan L-metionin (Jancova dan Siller, 2012).
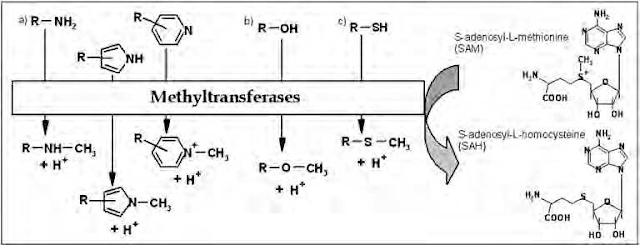 |
Gambar 5. Reaksi metilasi yang dikatalis metiltransferase
(Sumber: Jancova dan Siller, 2012)
|
Siklodekstrin (cyclodextrin) adalah oligosakarida siklis
hasik degradasi pati oleh enzim cyclodextrin glycosyl transferase 9CGT-ase)
yang tersusun atas molekul D-glokusa dengan ikatan α-1,4 glukosida. Dikenal ada
tiga macam siklodekstrin, yaitu α- β- dan γ- siklodekstrin yang masing-masing
tersusun atas 6, 7 dan 8 molekul glukosa. Siklodekstrin merupakan kristal
homogen, non-higroskopis dan berstruktur seperi cincin. Slikodekstrin mempunyai
kemampuan berinteraksi dengan bermacam-macam senyawa ionik dan molekular
membentuk suatu senyawa kompleks inklusi siklodekstrin. Oleh karena kemampuan
yang dimilikinya siklodektrin dapa dimanfaatkan sebagai bahan peng-inklusi
berbagai macam ingredien sehingga siklodekstrin dapat dimanfaatkan dalam
berbagai jenis industri seperti industri pangan, farmasi, pertanian, kimia
analisa dan lain-lain (Wahyuntari, 2005).
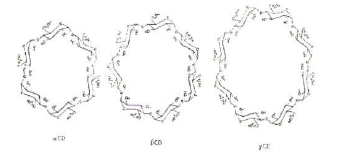 |
Gambar 6. Struktur kimia siklodekstrin
(Sumber: Szetjli, 1988 dalam Wahyuntari, 2005)
|
2.3 Fungsi Enzim Transferase
2.3.1
Menentukan Kode Gen
Protein arginin metilasi adalah enzim modifikasi dalam sel
eukariotik yang terlibat dalam transduksi sinyal, metabolisme pre-RNA dan proses
aktivasi transkripsi. Protein arginine N-methyltransferase (PRMT) membantu
dalam proses mencari genom manusia yang ditemukan pada kromosom 1 yang
mengkodekan methyltransferase PRMT6. Rantai polipeptida dari PRMT6 adalah 41,9
kDa yang terdiri dari urutan inti katalitik umum untuk enzim PRMT lainnya
(Frankel et al., 2002).
2.3.2
Menentukan Schizophrenia
DNA Methyltransferase adalah keluarga enzim yang memediasi
proses metilasi DNA sebagai komponen penting dari pemeliharaan tingkat
molekuler. DNMT (DNA Methyl Transferase) mengkatalisis transfer gugus metil
dari Sadenosyl metionin ke residu sitosin DNA. Ada terutama dua kelas
methyltransferases DNA; pemeliharaan methyltransferases (DNMT1) dan
methyltransferases novo de (DNMT3A & 3B). DNMT1 memiliki preferensi untuk
hemi alkohol DNA dan membantu dalam menjaga pola metilasi melalui generasi.
DNMT3A dan 3B menginduksi de novo metilasi untuk membangun jaringan pola
metilasi DNA tertentu selama pengembangan dan dalam menanggapi faktor
lingkungan. DNMT3L memiliki kekurangan yaitu kemampuan berinteraksi dengan DNA lainnya
mengikat protein di kompleks renovasi kromatin (Saradalekhsmi et al., 2014).
COMT adalah enzim yang terlibat dalam degradasi neurotransmitter
penting dopamin, epinefrin, norepinefrin (Weinshilboum et al., 1999 dalam
Sagud et al., 2010). Faktor keturunan memainkan peran dalam catechol
O--metil transferase (COMT) aktivitas (Weinshilboum dan Raymond 1977 dalam
Sagud et al., 2010), karena aktivitasnya memiliki distribusi bimodal
(Weinschilboum et al., 1974 dalam Sagud et al., 2010). Hipotesis
ini identifikasi polimorfisme genetik umum yang berhubungan dengan variasi tiga
sampai empat kali lipat dalam enzim COMT Kegiatan (Lachman et al., 1996 dalam
Sagud et al., 2010).
2.3.3
Menyembuhkan Gingivitis
Saliva adalah suatu cairan mulut yang kompleks, tidak
berwarna, dan disekresikan oleh kelenjar saliva mayor serta minor untuk
mempertahankan homeostasis dalam rongga mulut (Amerongen, 1991 dalam
Prameswari dan Handajani, 2010). Pada kelenjar saliva dapat ditemukan enzim glutathione
S-transferase (GST). Puy (2006) dalam Prameswari dan Handajani (2010),
menyebutkan salah satu kegunaan saliva adalah untuk mendiagnosis kelainan atau
perkembangan suatu keadaan patologis atau analisis penentuan dosis obat
(Campbell et al., 1991 dalam Prameswari dan Handajani, 2010) Glutathione
S-transferase merupakan enzim multifungsi yang memainkan peran penting pada
perlindungan sel dari kerusakan oleh bahan kimia toksik (Burg et al.,
2006 dalam Prameswari dan Handajani, 2010). Enzim ini berperan dalam
perubahan salah satu sitokin (leukotrien A4) menjadi produk hasil oksidasi asam
arakhidonat, salah satunya prostaglandin melalui jalur lipooksigenase
(Samuelsson, 1980). Rantai koagulasi, jalur asam arakhidonat, serta pembentukan
faktor pertumbuhan (growth factor), dan sitokin secara simultan bekerjasama
memulai dan mempertahankan fase inflamasi (Fishman dan Tamara, 2007 dalam
Prameswari dan Handajani, 2010). Edalat (2002) dalam Prameswari dan
Handajani (2010), melakukan suatu penelitian pada kolon tikus yang terinfeksi Lactobacillus
strain GG dan mendapatkan bahwa aktivitas GST semakin meningkat pada
kondisi inflamasi.
Pada akhir penelitian Prameswari dan Handajani (2010), diketahui
bahwa dibandingkan dengan konsentrasi 40%, ekstrak pegagan konsentrasi 50%
lebih baik dalam menurunkan aktivitas spesifik GST (Glutathione
S-transferase) saliva dan pada pemeriksaan klinis juga didapatkan penurunan
skor Indeks Gingiva. Dapat disimpulkan bahwa ekstrak pegagan konsentrasi 50%
mengindikasikan konsentrasi yang lebih baik dibandingkan konsentrasi 40% dalam
menyembuhkan gingivitis yang ditandai penurunan aktivitas spesifik GST saliva.
2.3.4
Menentukan Penyakit pada Hati
Gammaglutamyltransferase
(GGT) sering digunakan untuk
menilai fungsi sistem hepatobiliaris, seperti
pada infl amasi hati, penyakit perlemakan hati
(fatty liver
disease) dan penyalahgunaan alkohol (Emdin et
al., 2005; Mason et al., 2010 dalam Haurisssa, 2014). GGT
yang merupakan tes fungsi hati enzimatik generasi kedua ini, tersedia luas di
sebagian besar unit laboratorium klinis, telah digunakan sejak lebih dari 30
tahun, serta relatif memiliki tingkat sensitivitas tinggi (Emdin et al.,
2005; Mason et al., 2010 dalam Haurisssa, 2014). Oleh karena
karakteristik tersebut, GGT kemudian banyak diteliti sebagai biomarker (penanda
biologis) berbagai penyebab mortalitas dan risikonya (Emdin et al., 2005
dalam Haurisssa, 2014)
GGT adalah salah satu enzim dalam
serum, yang bekerja pada lini pertama proses degradasi ekstraselular glutathione
(GSH) (Emdin et al., 2005; Turgut, 2011 dalam Haurisssa,
2014) Glutathione adalah antioksidan utama sel mamalia yang berperan
penting dalam perlindungan sel dari oksidan. Jika stres oksidatif meningkat,
kebutuhan glutathione juga akan meningkat; jika kadar glutathione
rendah, maka kerusakan akibat stres oksidatif akan meningkat. Oleh sebab itu,
GGT diperkirakan memiliki peran penting di beberapa jenis jaringan atau organ.
Contohnya, organ paru yang secara fisiologis terus-menerus terpapar oksigen dan
rentan terhadap kerusakan oksidatif. Enzim GGT diproduksi di banyak jaringan,
sebagian besar dibuat di dalam organ hati dan dibawa oleh lipoprotein dan
albumin. GGT juga ditemukan di ginjal (terutama di tubulus renalis proksimal),
paru, pankreas, usus dan endotel vaskuler. Kadar GGT serum dipengaruhi oleh
beberapa faktor seperti: genetika, asupan alkohol, lemak tubuh, lipid plasma,
tekanan darah, kadar glukosa, kebiasaan merokok, dan berbagai konsumsi obat,
misalnya antikonvulsan dan obat-obatan (Haurisssa, 2014).
2.3.5 Aplikasi
pada Produk Pangan
Enzim transglutaminase mempunyai nama sistematika yaitu
amin-γ-glutamiltransferase yang
termasuk ke dalam kelas enzim transferase (E.C.2), asiltransferase (E.C.2.3),
aminoasiltransferase (E.C.2.3.2), protein glutamin- γ-glutamiltransferase dan mempunyai nama
alternatif yaitu fibrinoligase. Transglutaminase memiliki pH optimum berkisar
antara 5-8, tetapi pada pH 4 atau 9, transglutaminase masih menunjukkan
aktivitas enzimatik, suhu optimum untuk aktivitas enzimatik adalah 50-55oC
dan dapat melakukan aktivitas enzimatik terus menerus secara penuh meski
berlangsung pada suhu 500C selama 10 menit. Transglutaminase
kehilangan aktivitas enzimatik dalam beberapa menit pada pemanasan mencapai 700C.
Transglutaminase masih mengeluarkan aktivitas enzimatik pada suhu 100C,
dan masih menunjukkan beberapa aktivitas pada suhu sedikit di atas titik beku (Motoki
et al., 1986 dalam Mayashopha et al., 2015).
Salah satu produk transglutaminase yang telah dipasarkan
secara komersial dengan merk dagang ActivaTG. Produk ActivaTG telah dipasarkan
di luar negeri misalnya Eropa, USA, Korea, Jepang, Thailand dan beberapa negara
lainnya, termasuk di Indonesia. Di Indonesia, penggunaan enzim transglutaminase
pada skala industri sudah cukup banyak digunakan. Strain yang digunakan adalah Streptoverticillium
mobaraense, sehingga transglutaminase yang dihasilkan sering disebut
sebagai microbial transglutaminase (mTGase) (Puruhita, 2011 dalam Mayashopha
et al., 2015). Produk enzim mTGase dipasarkan oleh Ajinomoto dalam
bentuk serbuk putih yang terdiri dari beberapa komposisi yaitu enzim mTGase,
maltodextrin dan Na-casein. ActivaTG stabil disimpan dalam lemari pendingin
dengan suhu 210C selama 24 bulan. Komposisi produk ActivaTG terdapat
Na-caseinat sebagai substrat terbaik dari mTGase sehingga dapat dihasilkan
produk yang terbaik. Selain itu penggunaan siklodextrin berfungsi sebagai
penstabil mTGase (Cui et al., 2011 dalam Mayashopha et al.,
2015).
2.3.6
Penentu Obesitas
Seperempat anak dengan obesitas disertai
dengan peningkatan enzim transaminase, yaitu alanine aminotranferase (ALT) dan
aspartate aminotransferase (AST). Peningkatan ALT lebih mencerminkan penyakit
NAFLD dibandingkan penyakit hati kronis. Peningkatan ALT mengindikasikan adanya
resistensi insulin sehingga juga dipakai sebagai petanda diagnostik sindrom
metabolik (Vajro et al., 2000 dalam Wirawan et al., 2014).
Kadar enzim transaminase adalah kadar ensim transaminase hati yang meliputi
kadar ALT dan AST dengan satuan mg/dL. Peningkatan ALT pada anak apabila
kadarnya lebih dari 30mg/dL pada anak laki, atau lebih dari 19mg/dL pada anak
perempuan (Wirawan et al., 2014).
2.3.7 Terapi
Kanker
Tiopurin merupakan golongan obat yang
terdiri dari 6-merkaptopurin (komponen terapi pemeliharaan acute lymphocytic
leukemia [ALL] pada anak), tioguanin (sebagai terapi acute
myeloblastic leukemia [AML]) dan azatioprin (komponen yang sering diberikan
sebagai imunosupresi pada transplantasi organ, penyakit reumatik, dan gangguan
kulit). Prinsip mekanisme sitotoksik agen ini adalah penyatuan nukleotida
tioguanin (TGN) ke dalam DNA. 6-merkaptopurin merupakan prodrug yang
inaktif dan perlu dimetabolisme menjadi TGN agar bisa berfungsi sebagai agen
sitotoksik. Proses aktivasi ini dikatalisis oleh enzim hypoxanthine
phosphoribosyl transferase (HPRT). Selain itu, 6-merkaptopurin bisa
mengalami inaktivasi melalui oksidasi oleh enzim xantin oksidase (XO) maupun
melalui metilasi oleh enzim tiopurin metiltransferase (TPMT) menjadi metabolit
inaktif, yaitu 6-metilmerkaptopurin (6-MeMP) (Yudhani, 2014).
BAB III
PENUTUP
3.1 Kesimpulan
Dari
pembahasan diatas dapat ditarik kesimpulan sebagai berikut.
·
Enzim transferase adalah enzim-enzim yang mengkatalisis pemindahan
suatu gugus.
· Contoh
enzim transferase, yaitu UDP-glucuronosyltransferase, sulfotransferase, glutathione
s-konjugasi, N-acetyltransfrease, methyltransferase dan siklodekstrin.
· Fungsi
enzim transferase diantaranya adalah menentukan kode gen, menentukan
schizophrenia, menyembuhkan gingivitis, menentukan
penyakit pada hati, aplikasi
pada produk pangan, penentu obesitas dan terapi kanker.
DAFTAR PUSTAKA
Frankel, A., N. Yadav, J. Lee,
T. L. Branscombe, S. Clarke dan M. T. Bedford. 2002. The novel human protein arginine
N-Methyltransferase PRMT6 is a nuclear enzyme displaying unique
substrate specificity. The Journal of Biological Chemistry 277 (5):
3537-3543.
Haurissa, A. E. 2014. Gamma-glutamyltransferase
sebagai biomarker risiko penyakit kardiovaskuler. CDK
41 (11): 816-818.
Indah,
M. 2004. Enzim. Fakultas Kedokteran Universitas Sumatera Utara.
Jancova, P. dan
M. Siller. 2012. Topics on Drug Metabolism.
Editor: James Paxton. InTech Europe.
Mayashopha, A.
Y., F. Herfianita dan A. Sutrisno. 2015. Aplikasi enzim transglutaminase pada
produk pangan: kajian pustaka. Jurnal Pangan dan Agroindustri 3 (3)
1145-1151.
Prameswari, D. P. dan J.
Handajani. 2010. Efek berkumur ekstrak pegagan (Centella
asiatica (L.) Urban) konsentrasi 40% dan 50% terhadap aktivitas
spesifik glutathione s-transferase pada saliva penderita gingivitis
sedang. Majalah Obat Tradisional 15 (3): 138-145.
Saradalekshmi, K. S., N. V.
Neetha, S. Sathyan, I. V. Nair, C. M. Nair dan M. Banerjee. 2014. DNA Methyl
Transferase (DNMT) gene polymorphisms could be a primary event in epigenetic
susceptibility to Schizophrenia. Association of DNMT Polymorphisms in
Schizophrenia 9 (5): 1-8.
Trismilah, W. Sumaryono, A.
Malik Dan M. Sadikin. 2014. Isolasi dan karakterisasi protease serupa tripsin
(PST) dari Lactobacillus plantarum FNCC 0270. Jurnal Ilmu Kefarmasian
Indonesia 12 (1): 57-66.
Wahyuntari, B. 2005.
Siklodekstrin glikosil transferase dan pemanfaatannya dalam industri. Jurnal
Teknologi dan Industri Pangan 16 (3): 260-264.
Wibowo, U. 2006. Pengaruh pemberian formalin terhadap aktifitas enzim
tripsin pada feses sapi melalui uji gelatin. Skripsi. Fakultas
Kedokteran Hewan Institut Pertanian Bogor.
Wirawan, I. K. A., IGN
Sanjaya, PG Karyana dan IGL Sidiartha. 2014. Gambaran
enzim transaminase pada anak obesitas vegetarian. Sari Pediatri 15 (5):
289-293.
Yudhani, R. D. 2014.
Farmakogenomik dan terapi kanker. CDK
41 (6): 412-416.

Comments
Post a Comment